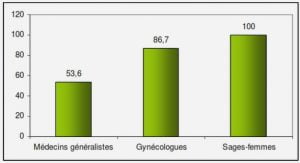
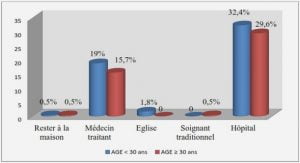
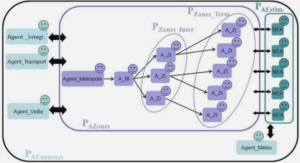
BIO-ECOLOGIE D’OREOCHROMIS NILOTICUS
Taxonomie et morphologie
Systématique
Oreochromis niloticus (Linnaeus, 1758) fait partie de l’Embranchement des Vertébrés, Classe des Ostéichtyens, Super Ordre des Téléostéens, Ordre des perciformes, Famille des Cichlidés, Genre Oreochromis et Espèce niloticus. Dernièrement, certains taxonomistes s’accordaient à diviser la tribu des Tilapiinés en quatre genres en se basant non seulement sur les caractères anatomiques, mais aussi, sur le comportement reproducteur et la nutrition (Trewavas, 1983) :
● incubation des œufs sur substrat avec garde biparentale, macrophytophages: Tilapia ;
● incubation buccale avec garde biparentale ou paternelle, planctonophages: Sarotherodon ;
● incubation buccale avec garde uniparentale maternelle, planctonophages: Oreochromis ;
● caractéristiques éco-morphologiques particulières ;
Caractéristiques morphologiques
Le corps est comprimé; la profondeur du pédicule caudal est égale à sa longueur. Les écailles sont cycloïdes et il y a absence de protubérance (knob) sur la surface dorsale du museau. La longueur de la mâchoire supérieure ne montre aucun dimorphisme sexuel. Le premier arc branchial compte 27 à 33 branchiospines. La ligne latérale est interrompue. Des rayons épineux et mous forment une ligne continue de la nageoire dorsale. Celle ci contient 16 à 17 épines et 11 à 15 rayons mous. La nageoire anale a 3 épines et 10 à 11 rayons. La nageoire caudale est tronquée. La couleur des nageoires pectorales, dorsale et caudale pendant la saison de frai devient rougeâtre; la nageoire caudale comporte de nombreuses lignes noires (Linnaeus, 1758).
Habitat et exigences écologiques
Le tilapia du Nil est une des espèces tropicales qui préfère vivre dans une eau peu profonde. Les températures létales inférieures et supérieures pour ce poisson sont 11-12°C et 42°C, respectivement, alors que les températures optimales varient entre 28 et 31°C. C’est un omnivore-brouteur, qui s’alimente sur le phytoplancton, le périphyton, les plantes aquatiques, les petits invertébrés, la faune benthique, les détritus et les films bactériens liés aux détritus. Le tilapia du Nil peut filtrer les aliments par occlusion intestinale des particules suspendues, y compris le phytoplancton et les bactéries, sur un mucus dans la cavité buccale, bien que sa nourriture principale soit le périphyton. La maturité sexuelle dans les étangs est atteinte après 5-6 mois. Le frai commence quand la température d’eau atteint 24°C. Le processus de reproduction commence quand le mâle marque un territoire, creuse un nid frayère sous forme de cratère et surveille son territoire. Les femelles matures frayent dans le nid, et juste après la fécondation par le mâle, collectent les œufs dans leur bouche et partent. La femelle incube les œufs dans sa bouche et couve les alevins après éclosion jusqu’à ce que leur vésicule vitelline soit résorbée. L’incubation et la couvaison durent 1 à 2 semaines, selon la température. Après, les alevins sont libérés mais en cas de danger, ils peuvent regagner en nageant la bouche de la femelle.
Pour le dimorphisme sexuel, la papille génitale du mâle est allongée (gonopode) alors que chez la femelle elle est courte et présente en son milieu une fente transversale (l’oviducte) située entre l’anus et l’orifice urétral. Ceci permet de distinguer les mâles des femelles dès que la taille atteint 12 cm (25 à 30 g) selon HUET, 1970 (Figure 3).
L’espèce est relativement euryhaline. Elle supporte des salinités de 0,015 pour mille à 30 pour mille. En ce qui concerne le pH, le tilapia tolère 5 à 11ppm. Les meilleures conditions sont proches de la neutralité. Quant à l’ammoniaque, elle existe sous deux formes dans l’eau: NH3 et NH4+ selon un équilibre chimique. La fraction toxique de l’ammoniaque (NH3) dissoute augmente avec le pH et lorsque le taux d’O2 diminue. Les Concentrations létales sont les suivantes : ammoniaque: NH3= 2.3 mg/l d’NH3 et nitrite: NO2 = 2.1 mg/L (Pauly et al., 1988).
Concernant l’oxygène dissous, l’augmentation du taux d’O2 dissous exerce une influence positive sur la croissance. La tension critique pour Oreochromis niloticus serait en dessous de 3 ppm d’O2 dissous. Sous cette concentration les croissances sont affectées. Au-delà de ce taux, les vitesses de croissances se stabilisent : la vitesse de croissance est la même à 5 ppm qu’à 3 ppm pour des poissons de 200 g. Sur des poissons plus petits, on observe une stabilisation de la vitesse de croissance à partir de 4 mg/l d’O2 dissous. Pratiquement en élevage, on cherchera à se maintenir au-dessus de 4 mg/l. Par ailleurs, on observe que la disponibilité en O2 dissous exerce une influence sur la croissance d’autant plus forte que le poisson est petit. La croissance se stabilise à partir de 1000 mg d’O2/Kg/h pour des poissons de 200 g, à partir de 1500 mg/kg/h pour des poissons de 20 g (Mélard, 1986).
Par rapport à la turbidité, les tilapias présentent une bonne tolérance allant jusqu’à 13 g de matières en suspension par litre (MES/l).
La croissance d’Oreochromis niloticus présente donc une extrême plasticité aux conditions fixées par le milieu. La croissance est sous la dépendance de multiples facteurs : physico-chimiques, physiologiques et environnementaux. A conditions égales, les vitesses de croissance augmentent avec la T° jusqu’à 27°C. Entre 27 et 31°C on n’observe pas de différences significatives en matière de croissance. Les valeurs 27°C-31°C constituent celles de la vitesse de croissance maximale. Cette influence de la température est d’autant plus forte que les poissons sont jeunes. A 27°C des poissons de 5 g grandissent 7 fois plus vite qu’à 21°C. Ce rapport est ramené à 4 pour des poissons de 300 g. Les larves et alevins sont donc plus exigeants en T° que les adultes (Ruwet et al., 1975).
A conditions comparables, les densités faibles débouchent sur des croissances plus élevées qu’à haute densité. En élevage intensif, les densités supérieures à 1000 ind/m² réduisent les croissances de façon très significative. Par ailleurs le sous-produit principal du métabolisme est l’ammoniaque. Il peut représenter jusqu’à 90% de l’azote total excrété. L’excrétion est sous la dépendance de la composition de l’aliment, principalement de sa teneur en protéine, de la température et du poids corporel.
Enfin, l’influence négative du taux de matières en suspension sur la consommation de nourriture a été mise en évidence. A contrario, le taux d’O2 dissous exerce un effet bénéfique sur l’efficacité alimentaire (Pauly et al., 1988).
|
Table des matières
I INTRODUCTION
II SYNTHESE BIBLIOGRAPHIQUE
II.1 BIO-ECOLOGIE D’OREOCHROMIS NILOTICUS
II.1.1 Taxonomie et morphologie
II.1.1.1 Systématique
II.1.1.2 Caractéristiques morphologiques
II.1.2 Habitat et exigences écologiques
II.2 PRODUCTION MONDIALE DU TILAPIA
II .2.1 Marché du tilapia
II.2.2 Situation et tendances
II.3 AQUACULTURE EN EAU DOUCE AU SENEGAL
II.3.1 Importance de l’aquaculture au Sénégal
II.3.2 Atouts physiques et potentiel aquacole du Sénégal
II.3.3 Pratiques et systèmes d’élevage
II.3.4 Initiatives et expériences
II.3.4.1 L’aquaculture en eau douce
II.3.5 Production
II.4 UTILISATION DES LIANTS DANS LA FABRICATION DES ALIMENTS EN AQUACULTURE
II.4.1 les principaux liants utilisés dans la formulation des aliments aquacoles
II.4.2 Les différents liants naturels utilisés dans cette étude
II.4.2.1 L’Adansonia digitata
II.4.2.2 La gomme arabique
II.4.2.3 Le Corchorus tridens
III MATERIEL ET METHODES
III.1 MATERIEL
III.1.1 Matériels biologiques
III.1.3 Matériel pour la fabrication des aliments
III.1.4 Matériel d’élevage
III.1.5 Matériel d’analyse et de traitement des données
III.2 METHODES
III.2.1 Sélection des liants naturels
III.2.2 Fabrication des aliments
III.2.3 Analyse biochimique des aliments
III.2.4 Cadre de l’étude
III.2.5 Conditions d’élevage
III.2.6 Suivi des paramètres physico-chimiques
III.2.7 Paramètres de croissance, de survie et d’efficacité alimentaire
IV RESULTATS ET DISCUSSION
IV.1 RESULTATS
IV.1.1 Les paramètres physico-chimiques
IV.1.2 Paramètres de croissance, d’efficacité alimentaire et de survie
IV.1.3 Les résultats de la composition bromatologique des aliments et de la chair des poissons
IV.1.4 Les résultats de l’analyse économique
IV.2 DISCUSSION
IV.2.1 Les paramètres physico-chimiques
IV.2.2 Paramètres de croissance, d’efficacité alimentaire et de survie
IV.2.4 L’analyse économique
V CONCLUSION ET PERSPECTIVES
REFERENCES BIBLIOGRAPHIQUES