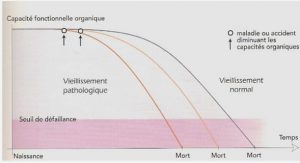
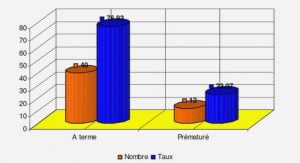
Télécharger le fichier pdf d’un mémoire de fin d’études
NEUROPHYSIOLOGIE DE LA DOULEUR
Mécanismes périphériques
Les Nocicepteurs
Les influx nociceptifs sont générés en périphérie par les terminaisons des fibres amyéliniques dans la peau, les tissus musculaires, articulaires et les viscères. Ce sont les nocicepteurs ou récepteurs périphériques de la douleur. Ils sont très nombreux, 200 /cm² et sont solidaires des artérioles et des veinules. Les influx sont ensuite véhiculés dans les fibres C et Aδ vers la moelle épinière.
Sont impliquées :
‐ Les fibres Aδ : peu myélinisées (diamètre : 1-5µm) conduisant l’influx nerveux à une vitesse moyenne de 4-30 ms. La douleur aiguë rapide est rattachée à l’activation de ces fibres.
‐ Les fibres C : non myélinisées (diamètre 0,3-1,5 µm) conduisant l’influx nerveux lentement (0,4-2ms. La douleur retardée correspond à l’activation des fibres C.
Les médiateurs périphériques
Outre leur capacité à réagir à certaines variations mécaniques et thermiques, un caractère commun à la majorité des nocicepteurs est probablement d’être des chémorécepteurs.
Il a été montré que certaines substances étaient algogénes, déclenchant l’influx :
‐ La bradykinine: l’un des plus puissants agents algogénes connus.
‐ La sérotonine : issue des agrégations des thrombocytes et de la dégranulation des mastocytes.
‐ Les ions H+ et K+.
D’autres sont sensibilisatrices :
‐ Les prostaglandines
‐ Les leucotriénes
‐ L’histamine : issue des granules de mastocytes.
Ces phénomènes de sensibilisation, c’est à dire d’abaissement du seuil d’activation d’un récepteur nociceptif sont très probablement responsables des phénomènes d’hyperalgésie observés dans les états inflammatoires
C ‘est dans leur action sur la synthèse des prostaglandines qu’il faut rechercher l’explication de l’action antalgique de certains anti-inflammatoires non stéroïdiens
‐ La substance P
Libérée par les terminaisons nerveuses aussi bien en périphérie qu’au niveau central, elle a des propriétés vasodilatatrices qui favorisent l’exsudation plasmatique. Cette substance P libérée provoque aussi la dégranulation des mastocytes. Cette dernière est à l’origine de la libération d’histamine qui va amplifier les processus vasculaires, activer et sensibiliser les nocicepteurs. C’est ce que l’on nomme aujourd’hui l’inflammation neurogène qui permet d’expliquer l’hyperalgésie en tache d’huile défendue par LEWIS.
Mécanismes spinaux de la nociception
Projections spinales des fibres périphériques
Après leur trajet dans les nerfs périphériques, les fibres afférentes rejoignent le système nerveux central par les racines rachidiennes postérieures ou leurs équivalents au niveau des nerfs crâniens.
Le plus fort contingent de fibres fines périphériques emprunte les racines postérieures où il occupe, une position latéroventrale. Ces fibres afférentes fines se subdivisent ensuite en une branche ascendante et une branche descendante qui cheminent sur quelques segments (jusqu’à six) dans le tractus de LISSAUER avant de se terminer dans la substance grise. La très grande majorité de ces fibres se termine dans les couches superficielles de la corne postérieure.
Neuromédiateurs des afférences primaires
Acides amines excitateurs
Le Glutamate, intervient dans le déclenchement des potentiels post-synaptiques rapides déclenchés dans la corne postérieure de la moelle par l’activation des fibres de gros diamètre.
Il existe 2 types de récepteurs à cet égard : le N-méthyl-D-aspartate et les autres non-NMDA.
Peptides
Un certain nombre de peptides, une vingtaine aujourd’hui, dont on peut soupçonner le rôle de neurotransmetteur, sont sélectivement concentrés dans les cellules du ganglion rachidien et les couches superficielles de la corne dorsale (couches I et II) ; ils sont présents dans les terminaisons des afférences fines myélinisées et non myélinisées. Il s’agit par exemple de la substance P, de la somatostatine, du peptide lié au gène de la calcitonine (CGRP) et de la cholecystokinine (CCK) mais aussi de la neurokinine A, du peptide intestinal vasoactif (VIP), de l’arginine vasopressine, de l’ocytocine, du peptide libérant de la gastrine (GRP), de la galanine, de l’angiotensine II, de l’hormone corticotrope (ACTH), sans oublier la dynorphine et les enképhalines.
– La substance P, décrite par Von Euler et Gaddum en 1931, mais isolée et identifiée 40 ans plus tard, ce neuropeptide est présent dans la moelle épinière. Cette substance P continue à retenir le plus d’attention quant à son rôle probable de neurotransmetteur ou, du moins de neuromodulateur des afférences nociceptives, c’est à dire d’une substance endogène qui, sans avoir d’effet propre, module les effets excitateurs ou inhibiteurs de neurotransmetteurs plus classiques.
A l’heure actuelle, la mise au point d’antagonistes spécifiques non peptidiques de la substance P et des récepteurs NMDA constitue un des axes majeurs de recherche pour la mise au point d’analgésiques.
Neurones spinaux impliqués dans la transmission de l’information nociceptive
Deux catégories principales de neurones répondant à des stimuli nociceptifs se dégagent de l’ensemble des études électrophysiologiques consacrées à la corne postérieure :
Neurones spécifiquement nociceptifs :
Exclusivement activés par des stimulations cutanées nociceptives mécaniques et/ou thermiques mettant en jeu des fibres Aδ et/ou C et leur champ récepteur est généralement de faible dimension. Bien que ces neurones répondent exclusivement aux stimulations nociceptives, leur capacité de codage de l’intensité de ces stimulations – notamment thermiques – semble cependant réduite.
Neurones à convergence :
Ils se caractérisent avant tout par leur capacité à répondre à la fois à des stimulations nociceptives diverses et à des stimulations mécaniques de faible intensité. Le terme qui les désigne résume leur caractéristique essentielle, à savoir celle d’être un lieu privilégié d’influences convergentes excitatrices et inhibitrices diverses. Suivant les auteurs, ils sont également désignés sous des termes variés : transporteurs communs « Common carriers », cellules gâchettes « trigger cells », neurones à large gamme dynamique « wide dynamic range cells », neurones à type couche V, neurones de classe 2, neurones multi réceptifs, ces termes étant équivalents.
Une propriété importante des neurones à convergence, qu’ils partagent d’ailleurs dans une certaine mesure avec les neurones spécifiquement nociceptifs, est leur capacité d’être également activés par des stimuli nociceptifs d’origine viscérale. Cette propriété, la convergence viscérosomatique pourrait représenter le substrat anatomique fonctionnel permettant d’expliquer le mécanisme de la douleur projetée : par exemple l’irradiation douloureuse vers le membre supérieur gauche dans l’angine de poitrine, la douleur testiculaire de la colique néphrétique, la douleur scapulaire droite de la lithiase vésiculaire.
Mécanismes supra spinaux de la nociception
Faisceaux Ascendants
On sait depuis longtemps que la majeure partie des messages nociceptifs croise la ligne médiane par la commissure grise antérieure après avoir été relayés par les neurones de la corne postérieure. La conduction de l’information nociceptive vers les centres supérieurs s’effectue par les faisceaux suivants :
Faisceaux spino-thalamiques
Les neurones à l’origine de cette voie se situent dans trois régions de la substance grise médullaire : la zone marginale, les couches IV-VI de la corne postérieure et les couches VII et VIII de la corne antérieure. Les axones des neurones de la corne postérieure cheminent dans le faisceau antérolatéral controlatéral et se projettent sur les régions latérales du thalamus : noyau ventro-postéro-latéral (VPL) et groupe postérieur (Po), faisceau néospinothalamique. Les axones des neurones de la corne antérieure cheminent dans la partie la plus médiane du cordon antérolatéral pour se terminer dans les régions médianes du thalamus : nucleus centralis latéralis (CL) ; faisceau paléospinothalamique.
Faisceaux spino réticulaires
Les mêmes trois régions de la substance grise médullaire donnent naissance à des neurones spino réticulaires impliqués dans la nociception. Les axones de ces neurones cheminent également dans le quadrant antérolatéral. Mais si la majorité d’entre eux croise la ligne médiane, il existe un contingent non négligeable qui reste ipsilatéral au corps cellulaire. Très schématiquement, il existe trois principales cibles réticulaire bulbaires : les noyaux gigantocellulaire et réticulaire latéral qui sont informés du caractère nociceptif d’une stimulation par des neurones dont les corps cellulaires sont essentiellement regroupés dans la corne antérieure (couche VII et VIII), et une région très caudale, le subnucleus reticularis dorsalis, qui reçoit des projections spinales issues essentiellement des couches I et V.
Faisceaux spino (ponto) mésencéphaliques
Sont concernés : la substance grise périaqueducale (SGPA) et l’aire para brachiale. La substance grise périaqueducale est informée du caractère nociceptif d’une stimulation par des neurones dont les corps cellulaires sont principalement localisés dans la corne postérieure (zone marginale, couches IV-VI) .Au niveau des projections vers l’aire para brachiale, les neurones d’origine sont principalement situés dans la zone marginale de la corne postérieure et les fibres ascendantes cheminent dans le funiculus postéro latéral.
Faisceau spinosolitaire
Issu notamment des couches I, V et X, ce faisceau se termine dans le noyau du tractus solitaire qui reçoit par ailleurs de nombreuses afférences vagales.
Fibres post synaptiques des cordons postérieurs
Les cordons postérieurs représentent classiquement le système spécifique des voies somesthésiques : responsables des sensations tactiles et kinesthésiques. Ils transfèrent sans modification des informations précises quant à la topie, la modalité, l’intensité et la durée des stimulations périphériques.
Ces voies contiennent des fibres de gros diamètre issues de la périphérie, dont les corps cellulaires sont situés dans les ganglions spinaux et qui se projettent sur les noyaux de GOLL et BURDACH (nucleus centralis et cuneatus) sans relayer dans la substance grise médullaire ; les neurones de ces derniers noyaux envoient leurs axones vers le noyau ventro-postéro-latéral (VPL) du thalamus controlatéral, après avoir décussé par les lemnisques médians. Cependant, le noyaux de GOLLet BURDACH renferment également des neurones de second ordre activés eux-mêmes par des neurones dont le corps cellulaires se trouve dans la corne postérieure ipsilatérale de la moelle (couches III-VI) et qui, du moins pour certains d’entre eux, répondent aux stimulations nociceptives. Il n’est donc pas impossible que certains de ces neurones transmettent l’information nociceptive vers le thalamus controlatéral.
En résumé, les neurones nociceptifs situés dans la corne postérieure de la moelle (neurones spécifiquement nociceptifs, neurones à convergence) se projettent essentiellement vers la formation réticulée, le mésencéphale et le thalamus latéral ; les projections thalamiques sont strictement controlatérales et les projections réticulaires bien que majoritairement controlatérales contiennent également un contingent ipsilatéral. La majorité de ces axones cheminent dans la voie antérolatérale.
Relais supra spinaux
Nous avons souligné la multiplicité des voies susceptibles de faire parvenir les messages nociceptifs aux centres supra spinaux .Ils y sont transmis sans modification depuis la moelle pour être profondément remaniés dans ces relais.
Le thalamus
Constitue sans contexte l’étage le plus étudié du fait probablement de la convergence vers certains de ses noyaux lemniscaux, spino-thalamiques et spino-réticulo-thalamiques. La complexité de l’organisation thalamique est soulignée par la multitude des voies susceptibles d’y acheminer les messages nociceptifs.
Ces dernières sont schématiquement de deux types dont les propriétés fonctionnelles sont différentes :
– Les voies néo-spino-thalamiques :
Qui se terminent dans le thalamus latéral, essentiellement le noyau ventro-postéro-latéral (VPL) et le groupe postérieur (Po) ;
– Les voies paléo-spino-thalamiques :
Qui se terminent dans le thalamus médian, essentiellement dans les noyaux centralis latéralis (CL) et submedius(Sm) ;
Les relais bulbaires
Le noyau gigantocellulaire (NGC) de la formation réticulée bulbaire reçoit des afférences issues de la corne antérieure de la moelle (couches VII, VIII) et comprend des neurones dont l’activité peut être influencée par stimulation nociceptive appliquée sur quasiment n’importe quel territoire corporel. Certains sont excités, d’autres inhibés. Ce noyau pourrait intervenir de trois façons dans la nociception :
De par ses projections vers le noyau raphé Magnus
Il pourrait agir sur les contrôles inhibiteurs bulbo spinaux.
De par ses projections spinales
Il pourrait participer à des mécanismes spino-bulbo-spinaux.
De par ses projections vers les noyaux centromédian et para fasciculaires (CM-PF) du thalamus qui eux-mêmes se connectent au striatum et au cortex pré moteur. On peut envisager son rôle dans les réactions motrices liées à la douleur.
Les relais pontomésencéphaliques :
L’aire para brachiale latérale, la région la plus intéressante, reçoit des afférences médullaires issues des neurones spécifiques nociceptifs de la couche I et comprend elle-même de nombreux neurones nociceptifs.
Par ailleurs on peut rencontrer des neurones répondant au stimulus nociceptif dans :
. la substance grise périaqueducale
. le noyau cunéiforme, cible majeure de projection de ces neurones nociceptifs, dont on peut attribuer un rôle important dans les processus émotionnels liés à la douleur.
Les relais corticaux
Les neurones du noyau ventro-postéro-latéral du thalamus se projettent sur le cortex somesthésique, on ne sera pas surpris de trouver dans ce dernier des neurones aux propriétés équivalentes. Cependant les réponses de type lemniscale sont enregistrées dans les couches superficielles alors que les neurones répondant aux stimuli nociceptifs sont situés plus profondément (couches V, VI).Le rôle du cortex dans la douleur est objet de controverse, ainsi toutes les tentatives anciennes d’ablation corticale dans le but de soulager des douleurs chroniques se sont soldées par des échecs.
Contrôle de la douleur
Contrôles segmentaires
La nature des inhibitions segmentaires a longtemps été controversée.
– Des inhibitions peuvent être déclenchées par stimulation des cordons post. Dans ce cas le prolongement central des fibres myélinisées de gros diamètre est probablement activé de façon antidromique, ce qui met en jeu secondairement et de façon orthodromique ses collatérales sous-jacentes se terminant dans la corne postérieure.
– On s’accorde aujourd’hui à leur attribuer des mécanismes à la fois pré et post synaptiques.
– Les auteurs sont également d’accord pour exclure l’hypothèse à priori concevable de l’intervention d’un mécanisme opioïde dans ces phénomènes puisqu’ils ne sont pas affectés par l’administration de naloxone.
– Il est cependant admis que leur origine est à rechercher dans la substance gélatineuse qui se trouve en position stratégique pour moduler le message nociceptif, contient de très nombreux inter neurones et dans laquelle les terminaisons axonales des fibres afférentes primaires forment des contacts complexes axodendritiques, dendroaxoniques, axoaxoniques, suggérant une riche modulation de la transmission de la voie afférente.
– La corne postérieure constitue donc une zone stratégique dans le traitement des informations nociceptives dés leur entrée dans le système nerveux central.
Contrôles d’origine supra spinale
Ces contrôles s’exercent depuis le tronc cérébral par les voies descendantes inhibitrices (VDI). Des contrôles d’origine thalamique, hypothalamique et corticale peuvent également être mis en évidence dans certaines conditions expérimentales mais ont été assez peu étudiés.
– La stimulation de certaines structures du tronc cérébral notamment la substance grise périaqueducale (SGPA) et certains noyaux du raphé est capable d’induire une profonde analgésie sans affecter semble-t-il les autres fonctions sensorielles. Cette analgésie résulte probablement de l’activation de voies inhibitrices descendantes qui bloquent la transmission spinale des messages nociceptifs.
-Les effets déclenchés depuis la substance grise périaqueducale s’exercent par l’intermédiaire du Nucleus Raphé Magnus (NRM) situé dans le bulbe. La stimulation électrique du NRM provoque d’ailleurs des analgésies encore plus puissantes que celles obtenues depuis la substance grise périaqueducale et une dépression prononcée des activités des neurones de la corne postérieure impliqués dans la transmission des messages nociceptifs.
Ces effets inhibiteurs s’exercent par l’intermédiaire de substances opioïdes endogènes puisqu’ils peuvent être diminués par l’administration systémique de naloxone, ce qui suggère que la stimulation centrale entraîne la libération d’endorphines.
Il pourrait s’agir des systèmes opioïdes médullaires que nous avons déjà évoqués, dans la mesure où l’administration intrathécale de naloxone bloque les effets analgésiques induits par stimulation du NRM. Le NRM se projette directement sur la moelle et nombre de ses neurones sont sérotoninergiques.
Des mécanismes noradrénergiques seraient aussi impliqués dans les contrôles bulbo spinaux des messages nociceptifs.
DOULEUR AIGUE ET DOULEUR CHRONIQUE
Douleur aiguë
La douleur aiguë est une sensation physiologique normale qui participe à la survie et à la protection de l’espèce. Sa principale caractéristique est la place qu’elle occupe dans le temps : elle est récente, transitoire, et disparaît rapidement.
Ressentie habituellement comme intense, elle est habituellement secondaire à l’activation du système de transmission du message douloureux.
Elle est provoquée par des agressions telles que la brûlure, la piqûre, les pincements.
Elle persiste le plus souvent jusqu’à la fin du processus de cicatrisation et disparaît en général avec le traitement de sa cause.
Elle constitue un signal d’alarme : elle va participer au diagnostic d’une lésion, témoigner de sa présence, et c’est elle qui va amener le patient à consulter.
Elle a plusieurs conséquences physiopathologiques, notamment endocriniennes et cardiovasculaires.
modifications neuroendocriniennes : augmentation de la sécrétion des hormones cataboliques (cortisol ; glucagon ; hormone de croissance ; catécholamines) et inhibition des hormones anaboliques (insuline et testostérone) responsable de l’hyperglycémie et de la négativité de la balance azotée avec augmentation de la production énergétique.
modifications cardiovasculaires : les influx nociceptifs activent le système sympathique et stimulent la libération locale et systémique de catécholamines avec tachycardie ; hypertension artérielle et élévation du débit cardiaque. L’augmentation des résistances vasculaires et de la contractilité cardiaque sont des facteurs d’accroissement de la consommation d’oxygène du myocarde.
Douleur chronique
Qu’elle soit symptomatique d’une maladie encore évolutive (cancer, pathologie rhumatismale) ou qu’elle résulte de séquelles traumatiques ou chirurgicales (avulsions plexiques, amputations de membre) ou d’une maladie guérie (douleur post-zostérienne), la douleur chronique va avoir des répercussions physiques et psychologiques. Elle n’a plus aucune fonction ni aucun objectif biologique : elle est devenue <<. Maladie>>. Elle va conditionner la vie de l’individu, envahir son univers affectif, retentir sur son vécu quotidien avec des répercussions sociales, professionnelles et familiales. Elle va mobiliser la totalité des structures nerveuses et va devenir la préoccupation dominante. On admet de façon arbitraire qu’une douleur devient chronique lorsqu’elle dure plus de trois mois à six mois.
DOULEUR POST-OPERATOIRE
Physiopathologie de la douleur post- opératoire
La douleur post-opératoire est une douleur aiguë par excès de nociception. La lésion chirurgicale déclenche un processus inflammatoire qui stimule les nocicepteurs au niveau de la peau, des muscles, des aponévroses, des os ou des viscères : on a alors une douleur localisée. La stimulation répétée des nocicepteurs avec le réveil des récepteurs silencieux provoque une augmentation de l’amplitude et un accroissement du nombre de potentiels d’action. C’est le phénomène du remontoir ou « Wind up ».
Déterminants de la douleur post-opératoire
De multiples facteurs concourent à la genèse de la douleur post-opératoire et rendent compte de ses principaux caractères et de sa variabilité. L’opéré, le chirurgien, l’anesthésiste et l’infirmier sont les quatre principaux acteurs de la période péri opératoire et, si la nature et le siège de la chirurgie sont les déterminants les plus apparents, l’anesthésiste, l’analgésie et les facteurs d’origine psychique y tiennent de toute évidence une place non négligeable.
L’importance des différents déterminants et de leurs variations permet de comprendre que les besoins analgésiques puissent différer considérablement d’un malade à un autre et que l’efficacité de l’analgésie ne repose pas totalement sur des choix pharmacologiques et techniques [63].
Déterminants psychiques
Pour une même intervention, l’intensité de la douleur post-opératoire peut varier dans des proportions considérables d’un individu à l’autre. De plus, pour un même individu, la douleur et son expression sont très variables d’un jour à l’autre et d’une période à l’autre de la journée.
Les interférences psychiques sont nombreuses parmi lesquelles la peur, l’anxiété, la solitude, la sensation d’impuissance et de perte de contrôle de soi, l’incertitude de l’avenir en terme de santé…
D’autres facteurs sont plus controversés ; tels que l’âge, le sexe, l’existence d’une anxiété constitutionnelle, d’une émotivité excessive ou le caractère extraverti d’un individu. Ces facteurs sont habituellement avancés pour expliquer les différences de perception de la douleur et de la réponse aux antalgiques. On ne peut exclure que la perception de la douleur puisse être altérée chez les personnes âgées telle que l’audition et la vision. Leur moindre perception de la douleur a été évoquée en raison d’une différence de réponse aux morphiniques, ce groupe de patient étant plus facilement soulagé par des doses plus faibles et pour des périodes plus longues. Il s’agit en fait d’une différence de nature plus pharmacocinétique que de nature physiologique. Il a été également montré que les jeunes enfants ont, dès leur naissance, un système nerveux mature qui leur permet de percevoir la douleur.
Une éventuelle différence de réponse à la douleur entre hommes et femmes pourrait s’expliquer par le fait que les femmes au cours de leur existence seraient plus souvent confrontées à la douleur que les hommes ; des différences de nature culturelle pourraient également être en cause…
Des éléments psychosociologiques influencent les réponses individuelles à une intervention chirurgicale. On peut les séparer en facteurs prédisposant (personnalité et traits de caractère, intelligence, niveau culturel, histoire familiale et sociale) sur lesquels il est difficile d’intervenir pendant la période post-opératoire ; et en facteurs spécifiques, dus à la situation particulière de la période péri opératoire, sur lesquels des interventions plus spécifiques sont possibles.
La personnalité affecte la sensation douloureuse ou l’expression de la douleur. Anxiété, névrose, et extraversion sont habituellement décrits comme des facteurs intervenants sur le niveau la douleur post-opératoire. L’anxiété est un élément essentiel. Elle peut être présente avant l’intervention ou bien n’être que contemporaine à la douleur post-opératoire voire en être sa résultante. On différencie l’anxiété état (due à un état réactionnel) et l’anxiété trait (prédisposition générale à réagir de façon émotionnelle à une situation de stress). Les patients qui présentent cette dernière caractéristique ont en principe tendance à ressentir un niveau de douleur post-opératoire plus important.
L’anxiété modifie la capacité du patient à répondre à une injection d’un médicament antalgique.
Un sujet calme fera facilement la différence entre un antalgique et un placebo par exemple, alors qu’un sujet anxieux ne le pourra pas.
La motivation occupe une place non négligeable dans la douleur post-opératoire :l’analgésie est obtenue de façon plus aisée si l’acte (chirurgical) opératoire est accepté ou désiré.
C’est le cas lors d’une chirurgie pour affection curative par opposition à une chirurgie palliative pour cancer.
Déterminants chirurgicaux
La nature et le siège de l’intervention sont les facteurs essentiels. Les chirurgies abdominales et ou thoraciques, la chirurgie articulaire prothétique et ligamentaire et la chirurgie rachidienne sont ainsi plus algogénes que la chirurgie abdominale basse ou de l’extrémité céphalique. On ne négligera pas le caractère excessivement douloureux d’interventions réputées moins délabrantes comme la chirurgie corrective complexe du pied ou la chirurgie hémorroïdaire.
D’autres facteurs conditionnent l’intensité et la durée de la douleur post-opératoire comme le type d’incision : Les incisions qui sectionnent les fibres étant évidemment moins douloureuses que celles qui les écartent.
|
Table des matières
INTRODUCTION
PREMIERE PARTIE
1. MECANISMES GENERATEURS DE LA DOULEUR
1.1 Douleurs par excès de nociception
1.2 Douleurs après lésion du système nerveux : douleurs par désafférentation
2. NEUROPHYSIOLOGIE DE LA DOULEUR
2.1 Mécanismes périphériques
2.1.1 -Les Nocicepteurs [13, 56]
2.1.2 -Les médiateurs périphériques [12, 23, 31,69]
2.2 Mécanismes spinaux de la nociception [33, 51,67]
2.2.1 Projections spinales des fibres périphériques
2.2.2 Neuromédiateurs des afférences primaires [39, 58]
2.2.2.1 Acides amines excitateurs
2.2.2.2 Peptides
2.2.3 Neurones spinaux impliqués dans la transmission de l’information nociceptive [64, 66, 68]
2.2.3.1 Neurones spécifiquement nociceptifs :
2.2.3.2 Neurones à convergence :
2.3 Mécanismes supra spinaux de la nociception
2.3.1 Faisceaux Ascendants [65]
2.3.1.1 Faisceaux spino-thalamiques
2.3.1.2 Faisceaux spino réticulaires
2.3.1.3 Faisceaux spino (ponto) mésencéphaliques
2.3.1.4 Faisceau spinosolitaire
2.3.1.5 Fibres post synaptiques des cordons postérieurs
2.3.2 Relais supra spinaux [8, 34, 35]
2.3.2.1 Le thalamus
2.3.2.2 Les relais bulbaires
2.3.2.3 Les relais pontomésencéphaliques :
2.3.2.4 Les relais corticaux
2.4. Contrôle de la douleur
2.4.1 Contrôles segmentaires [46, 64, 66]
2.4.2 Contrôles d’origine supra spinale [30, 65, 68]
3. DOULEUR AIGUE ET DOULEUR CHRONIQUE
3.1 Douleur aiguë [61]
3.2 Douleur chronique [57]
4. DOULEUR POST-OPERATOIRE
4.1 Physiopathologie de la douleur post- opératoire
4.2 Déterminants de la douleur post-opératoire
4.2.1 Déterminants psychiques [25,26]
4.2.2 Déterminants chirurgicaux [17, 19]
4.2.3 Déterminants anesthésiques [63]
4.2.4 L’information du malade [16, 52, 59, 60]
4.3 Conséquences de la douleur postopératoire [4, 9, 17]
4.3.1 Répercussions métaboliques de la douleur postopératoire
4.3.2 Conséquences de la douleur post-opératoire sur les différentes fonctions
4.4 Prise en charge de la douleur post-opératoire
4.4.1 Evaluation de la douleur post-opératoire [8, 17, 18, 57]
4.4.2 Techniques d’analgésie [5, 18]
4. 4. 2. 2 Analgésie locorégionale
4. 4. 2. 3 Analgésie multimodale
4.5 Organisation de la prise en charge de la douleur postopératoire
1. MATERIEL ET METHODE
2. Résultats
2.1 Répartition des praticiens
2.1.1 Selon l’âge.
2.1.2 Selon le sexe
2.1.3 Selon la fonction
2.1.4 Selon la structure
2.2 Répartition selon les questions
2.2.1 Connaissez-vous les différents scores de la douleur ?
2.2.2 Evaluez-vous la douleur en post-opératoire ?
2.2.3 Quelle méthode d’évaluation utilisez-vous ?
2.2.4 Avez-vous reçu une formation pour la prise en charge de la DPO ?
2.2.5 Pourquoi n’évaluez vous pas la douleur ?
2.2.6 Qui prescrit l’analgésie post opératoire ?
2.2.7 L’administration d’antalgique est elle systématique en post opératoire ?
2.2.8 Modalités de prescription
2.2.9 A quel moment est débutée l’analgésie post-opératoire ?
2.2.10 Quelles sont les méthodes d’analgésie utilisées ?
2.2.11 Surveillance du traitement analgésique
2.2 .12 Produits utilisés
2.3. Répartition des réponses selon la fonction
2.3.1 Connaissance des scores, évaluation de la douleur, méthodes d’évaluation
2.3.2 Avez-vous reçu une formation pour la prise en charge de la douleur postopératoire ?
2.3.3 Pourquoi n’évaluez-vous pas la douleur ?
2.3.4 Modalités de prescription
2.3.5 Surveillance du traitement antalgique
2.4 Répartition des réponses selon les structures
2.4.1 Connaissance des scores, évaluation de la douleur, méthodes d’évaluation
2.4.2 Avez-vous reçu une formation pour la prise en charge de la DPO ?
2.4.3 Pourquoi n’évaluez-vous pas la douleur post-opératoire ?
2.4.4 Qui prescrit l’analgésie post-opératoire ?
2.4.5. Modalités de prescription
2.4.6 À quel moment est débutée l’analgésie post-opératoire ?
2.4.7 Quelles sont les méthodes d’analgésie utilisées ?
2.4.8 Surveillance du traitement antalgique
CONCLUSION
BIOBLIOGRAPHIE
Télécharger le rapport complet