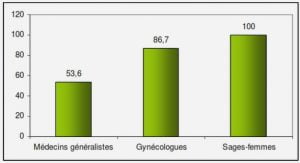
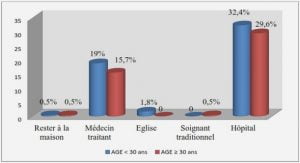
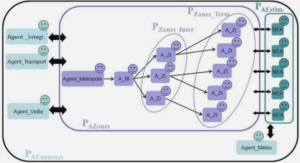
Télécharger le fichier pdf d’un mémoire de fin d’études
La fonctionnalisation du fullerène C60
A cause de la faible délocalisation des électrons π, le C60 présente une réactivité similaire aux alcènes déficients en électrons et réagit donc facilement avec les espèces riches en électrons.
Les réactions de fonctionnalisation du C60 sont nombreuses, nous ne les détaillerons pas toutes. Une grande quantité de dérivés du C60 ont été obtenus par deux méthodes essentiellement : les additions nucléophiles (réaction de Bingel), les cycloadditions [4+2] et [3+2], c’est pourquoi nous développerons plus particulièrement ces deux réactions (figure 4).
Les doubles liaisons des C60 sont de bons diénophiles. Ainsi, le fullerène peut réagir avec différents diènes par une réaction de cycloaddition de type Diels-Alder.
Dans le premier exemple de réaction de Diels-Alder le C60 a été mis à réagir avec le cyclopentadiène.7 L’addition du cyclopentadiène à une solution de fullerène dans le toluène à température ambiante a conduit à un produit de mono-addition avec 74% de rendement.
Réaction de Bingel
La réaction de Bingel,8 mise au point 1993, est une cyclopropanation. Le carbanion généré in situ, obtenu par déprotonation par NaH ou DBU (1,8-diazabicyclo [5.4.0]undec-7-ene) d’un-haloester ou d’une-halocétone, est additionné sur le C60. Le dérivé intermédiaire RC60-,après la réaction de substitution nucléophile intramoléculaire suivie du départ de l’ion halogènure conduit alors à un méthanofullerène. L’addition nucléophile se fait sur une double liaison entre deux hexagones. Un exemple est représenté avec la figure 5.
Réaction de cycloaddition [3+2] de Prato
La réaction de Prato9.10 est un exemple de réaction de cycloaddition [3+2] à partir des ylures d’azométhine qui sont des dipôles 1,3 très réactifs. Ces ylures sont générés in situ après décarboxylation de sels d’iminium, formés par condensation d’acides aminés sur des aldéhydes. Ces ylures vont ensuite réagir sur le C60 pour former des fulléropyrolidines (figure 6).
La diversité dans le choix de l’aldéhyde et de l’acide aminé permet alors la préparation d’un grand nombre de fulleropyrrolidines substituées. Grâce à ce fait, cette procédure est la plus couramment utilisée aujourd’hui pour fonctionnaliser le C60.
Les nitriles imines
La fonctionnalisation décrite par Langa et al. est une cycloaddition [3+2] qui conduit à des pyrazolino[60]fullerènes.11 Le dipôle 1,3 est généré in situ à partir d’un aldéhyde et d’une phénylhydrazine en présence de triéthylamine. Cette réaction permet d’obtenir rapidement une fonctionnalisation du C60 avec de bons rendements.
Réaction de multi-additions
Après la première fonctionnalisation, les liaisons [6,6] restantes du C60 ne sont pas identiques et, en principe, 8 différents régioisomères peuvent être formés par addition d’un second adduit. A cause de sa structure tridimensionnelle et de sa symétrie, la polyaddtion sur le fullerène C60 est susceptible de conduire à un grand nombre de composés possédant des symétries particulières et pouvant être chiraux.
La nomenclature IUPAC12 peut être utilisée pour nommer les différents régioadduits. Cependant on utilise généralement une description différente proposée par Hirsch.13 Les différentes positions d’un second adduit par rapport à une première fonctionnalisation sont appelées cis-n (n = 1–3) (quand ils sont situés dans le même « hémisphère »), équatorial (e) et trans-n (n = 1–4) (quand ils sont situés dans l’autre « hémisphère ») (figure 7).
La double cyclopropanation du C60 par la réaction de Bingel avec le diéthyl 2-bromomalonate conduit à la formation de 7 isomères, qui ont été isolés par chromatographie (figure 8a).14
En 2001, Prato et ses collègues ont isolé et caractérisé avec succès les 8 bis adduits formés par une double réaction de cycloaddition 1,3-dipolaire (figure 8b).15
Alors que les bis adduits de fullerène peuvent être purifiés relativement facilement, il n’en va pas de même pour les tris et tétra adduits du fait du très grand nombre de régioisomères qui peuvent être formés. Dans ce cas, il faut recourir à des templates qui permettent d’obtenir un seul ou un nombre limité de régioisomères. Cette approche a été particulièrement étudiée par le groupe d’Andreas Hirsch.16 En fonction de la taille des chaînes entre les groupements malonates, des régioisomères différentes peuvent être formées et ceci de façon sélective. La réaction de cyclo-[3]-octylmalonate avec du C60 conduit principalement au e,e,e-trisadduit avec un sous-produit minoritaire : le trans-4, trans-4, trans-4-trisadduit. Tandis qu’avec le cyclo-[3]-tétradecylmalonate dans la même condition, le trans-3, trans-3, trans-3-trisadduit est isolé comme le seul produit de réaction (figure 9).
Porphyrines et phtalocyanines
Les Porphyrines
Structure et nomenclature
Les porphyrines sont des molécules macrocycliques composées de 4 unités pyrroles reliées par des ponts méthynes (CH) (figure 10). Elles peuvent complexer de nombreux cations ; elles sont impliquées dans le transport de l’oxygène lorsque ce cation est du fer. Elles entrent alors dans la composition de l’hémoglobine et dans un grand nombre de protéines ayant pour fonction l’oxydation. Lorsque le cation central est du magnésium (II), ces molécules sont la base de la chlorophylle qui est impliquée dans la photosynthèse.
Les porphyrines sont des macrocycles fortement conjugués. Ces composés présentent un squelette de base aromatique, l’aromaticité étant due à un système de 26 électrons π. De ce fait, ces macrocycles présentent une grande stabilité ainsi qu’une forte coloration. En outre, les porphyrines se comportent en fonction du pH comme des diacides ou des dibases, ce qui entraîne leur métallation par presque tous les métaux.17 Lorsqu’elles ne sont pas métallées, elles portent le nom de porphyrines bases libres.
Les phtalocyanines
Structure
L’origine du mot phtalocyanine (Pc) vient du mot grec « naphta » qui décrit un caractère visqueux ou huileux, et « cyanine » qui traduit une couleur bleue foncée portant sur le vert. Les phtalocyanines sont des macrocycles formés par quatre groupements isoindoles qui constituent un système aromatique plan de 42 électrons π (figure 17).25
Contrairement aux porphyrines, macrocycles proches par leur structure et qui sont des molécules essentielles à certaines fonctions biologiques, les phtalocyanines ne sont pas présentes dans la nature. La phtalocyanine est un colorant synthétique employé dans l’industrie pour fabriquer des encres. Les pigments à base de phtalocyanine ont été développés dans les années 1930 et sont très utilisés aujourd’hui dans la fabrication des peintures.
Les phtalocyanines sont des tétrabenzoporphyrines dans lesquelles les quatre atomes de carbone des ponts méthynes liant les sites pyrroliques sont remplacés par des atomes d’azote. Par conséquent, les phtalocyanines sont aussi appelées tétraaza-tétrabenzoporphyrines ou tétrabenzoporphyrazines. Les différences entre porphyrines et phtalocyanines peuvent être résumées de la façon suivante :
• Le système d’électrons π des phtalocyanines est plus délocalisé que celui des porphyrines en raison de la présence des noyaux aromatiques fixés sur les pyrroles,
• La taille de la cavité formée par les quatre atomes d’azote pyrroliques est plus petite d’environ 0,05 Å dans le cas des phtalocyanines.
Par ailleurs, les phtalocyanines sont stables chimiquement et thermiquement. Les phtalocyanines ont la possibilité d’incorporer au sein de leur cavité 70 différents cations métalliques. 26
Réaction « Click-Chemistry » et fonctionnalisation du fullerène C60 par la CuAAC
La click-chemistry
Généralité
Les applications de la « click-chemistry », avec plus de 1400 publications parues à ce jour, recouvrent de vastes domaines.32 Elles concernent la chimie thérapeutique, les sciences des matériaux, la biochimie, la chimie macrocyclique etc. Le terme « click-chemistry » définit un ensemble de réactions qui répondent à tous ou au maximum des critères suivant énoncés par Sharpless:33
• être de large portée, et donner de bons rendements
• respecter le principe d’économie d’atomes
• générer des sous-produits inoffensifs qui pourront être éliminés par des méthodes non-chromatographiques
• être régiospécifique.
• l’utilisation de matériels et réactifs facilement disponibles
• l’absence de solvant ou l’utilisation de solvants verts
• une isolation simple du produit par cristallisation ou distillation
• compatible avec les conditions atmosphériques (présence d’eau et d’oxygène)
Parmi les réactions de « click-chemistry », la réaction qui a connu un essor considérable ces dernières années est la cycloaddition 1,3-dipolaire de Huisgen entre un azoture et un alcyne terminal (figure 20).34 Optimisée par Sharpless et Meldal,35.36 cette réaction catalysée par le cuivre (I) conduit à la formation chimio- et régiosélective de 1,2,3-triazoles 1,4-disubstitués.
La cycloaddition entre un alcyne et un azide catalysé par le cuivre (CuAAC) répond à un grand nombre des critères énoncés par Sharpless. Il faut cependant noter que la présence d’oxygène doit être évitée à cause du catalyseur de Cuivre (I).
Auto-assemblages de fullerènes est un composé fortement hydrophobe et volumineux avec une parfaite symétrie icosaédrique.
Compte tenu de ces propriétés optiques et électroniques, le fullerène est encore largement étudié pour la fabrication des matériaux fonctionnels: cellules photovoltaïques,47 diode électroluminescente organique (OLED) (Organic Light-Emitting Diode),48 transistor organique à effet de champ (OFET) (Organic Field Effect Transistor),49 etc… Le bon fonctionnement de ces dispositifs optoélectroniques est souvent conditionné par l’organisation supramoléculaire du fullerène dans le matériau. Ainsi il est crucial pour l’optoélectronique organique de maitriser les aspects d’organisation supramoléculaire.
Dans cette partie, nous essayerons de décrire de façon complète des différents systèmes d’auto-organisation du C60.
A ce jour, beaucoup d’exemples de polymères supramoléculaires contenant du fullerène sont connus et il est possible de les classer en 4 types selon la stratégie de synthèse, suivie pour leur préparation, comme représenté dans la figure 26:50 a) interactions entre les polymères fonctionnalisés avec des dérivés de C60 ; b) auto-assemblage de dérivés de C60 ; c) C60 multi-fonctionnalisé avec des polymères ; d) interaction entre le C60 non fonctionnalisé avec les groupements complexants.
Polymère supramoléculaire de fullerène
Interactions fullerène-polymère (approche a)
L’équipe de Goh a obtenu un polymère supramoléculaire en mélangeant un dérivé de C60 contenant un groupement acide carboxylique avec un polymère accepteur de proton (copolymère de styrène PS et de poly(4-vinylpyridine) P4VP) (figure 27).51
Le fullerène 5 a une solubilité très limitée dans les solvants organiques et est seulement légèrement soluble dans le 1,2-diclorobenzène. Par contre, le matériau supramoléculaire se dissout facilement dans le THF et le chloroforme, qui sont de bons solvants pour le polymère 7. Les études réalisées par microscopie électronique en transmission ont clairement montré la différence de morphologie entre des complexes C60 non fonctionnalisés/7 et des complexes 5/7 (figure 28). Utilisant le même polymère 7 et le dérivé de C60 6, Shinkai et ses collègues ont montré la formation d’agrégats supramoléculaires 20-30 nm dans la 3-pentanone (figure 29).52 La faible solubilité du fullerène complexé avec le bloc P4VP et la grande solubilité du bloc PS dans la 3-pentanone entraîne la formation de blocs de polystyrène orientés vers l’extérieur, alors que le fullerène se retrouve à l’intérieur des micelles.
Auto-assemblage des dérivés du C60 (approche b)
Hummelen et ses collègues53 ont préparé un polymère supramoléculaire à partir d’un monomère auto-complémentaire capable de former quatre liaisons hydrogènes (figure 30).
Fullerène multi-adduits et polymères (approche c)
En 1998, Liming Dai et ses collègues ont assemblé des fullerènes portant des groupements sulfonate sur des polyanilines.54.55 Ils ont démontré que l’assemblage de C60 sur la polyaniline avait pour effet d’augmenter de manière significative la conductivité du polymère (figure 31).
Le groupe de Yashima a assemblé des bis-adduits de fullerène chargés positivement sur un polyphénylacétylène portant des groupements monoéthyle phosphonate.56 Trois bis-adduits chiraux trans-3, trans-2, cis-3 ont été synthétisés et complexés avec le polymère. Yashima a montré que le trans-3 pouvait induire la formation d’hélice (figure 32) alors que les autres composés (chiraux eux aussi) ne le pouvaient pas. Cet effet du composé trans-3 a été attribué à une bonne adéquation des distances entre les deux fonctions sur le fullerène et les groupements phosphonates du polymère.
Assemblages bio-dirigés
Contexte
Parmi les nouvelles méthodes d’assemblages basées sur l’approche « bottom-up », la chimie supramoléculaire et l’assemblage bio-dirigé sont très prometteurs. Les processus biologiques, et en particulier l’hybridation de l’ADN, offrent une importante possibilité pour le contrôle de l’auto-assemblage à une échelle nanométrique.
L’ADN est utilisé depuis quelques années comme un matériau de construction à l’échelle nanométrique grâce à ses capacités de reconnaissance et d’auto-assemblage. Ces dernières années, la conception de nanostructures à base d’ADN a été révolutionnée par le développement de méthodes assez simples et rapides qui permettent de « programmer » l’ADN afin qu’il donne naissance à des formes spécifiques. La clé de cette approche est la reconnaissance entre différents motifs d’ADN : une séquence d’oligonucléotides ne peut se lier spécifiquement qu’avec sa séquence complémentaire par le processus d’hybridation.
ADN
Structure de l’ADN
L’acide désoxyribonucléique ou ADN est une molécule, présente dans toutes les cellules vivantes, il renferme l’ensemble des informations nécessaires au développement et au fonctionnement d’un organisme. C’est aussi le support de l’hérédité car il est transmis lors de la reproduction, de manière intégrale ou non. Il porte donc l’information génétique, il constitue le génome des êtres vivants.
L’ADN est composé de séquences de nucléotides; on parle de polymère de nucléotides ou encore de polynucléotide. Un nucléotide est formé par un groupe phosphate, du désoxyribose (sucre) et une base azotée. Chaque base est fixée sur un désoxyribose qui est lié à deux phosphates. Dans l’ADN, les nucléotides sont reliés entre eux selon une certaine séquence grâce à des liaisons impliquant un groupe phosphate, qu’on appelle des liaisons 5′-3′ phosphodiester. Un « brin » d’ADN est formé par la répétition ordonnée de ces nucléotides (figure 44).
La thymine (T) et la cytosine (C) sont de la famille des pyrimidines. L’adénine (A) et la guanine (G) sont de la famille des purines. En effet, il n’existe que deux types 34 complémentaires de bases : une pyrimidine sera toujours en face d’une purine, l’adénine s’associant avec la thymine et la guanine avec la cytosine. Les bases azotées complémentaires sont reliées entre elles par des liaisons hydrogène (figure 45). Ce sont les quatre bases azotées qui assurent la variabilité de la molécule d’ADN, ainsi que la complémentarité des deux brins. Il existe une interaction à deux liaisons hydrogènes entre adénine et thymine et trois liaisons hydrogènes entre guanine et cytosine. Les interactions G/C sont donc légèrement plus stables que les interactions A/T.
Selon la composition du milieu extérieur, en particulier le pourcentage d’eau lié aux phosphates, la double-hélice d’ADN peut adopter trois structures (figure 46):
– 95% d’eau : type B
– 70% d’eau : type A
– 50% d’eau : type Z
La forme d’ADN la plus commune est le type B. L’ADN est une molécule de taille nanométrique: pour la double hélice d’ADN-B, le diamètre est d’environ 2 nm et le pas de l’hélice est d’environ 3,4 nm.
Intérêt de l’ADN comme brique de construction
Auto-assemblage 2D
Nadrian C Seeman est un pionner dans le domaine d’auto-assemblage à base d’ADN. Il a été le premier a proposé la construction des briques dites intelligentes faites par des molécules d’ADN. L’idée principale est basée sur le schéma suivant: combiner plusieurs monobrins d’ADN pouvant former des structures en T ou en croix (appelé jonction d’Holliday) et possédant à leurs extrémités des bases non appareillées (appelés bouts collants) qui vont permettre d’assembler les structures primaires entre elles (figure 47).74
La flexibilité de l’ADN est un des problèmes les plus difficiles à résoudre pour la construction des nanostructures. Pour résoudre ce problème, Seeman et ses collègues ont introduit un concept très astucieux qui consiste à entrecroiser plusieurs monobrins d’ADN et ainsi former deux double-hélices parallèles partageant des brins.75 Ces séquences sont appelées « double crossover », elles permettent d’obtenir des structures rigides (figure 48).
Ces nouvelles briques de bases ont été largement utilisées pour la fabrication de nanostructures. Par exemple, en 2003 Yan et La Bean ont décrit la formation de croix comportant les séquences de type « double crossover » portant des bouts collants. Ces structures sont capables de s’auto-assembler afin de former des nanorubans ou des nanogrilles (figure 49).76
Auto-assemblage 3D à base d’ADN
Le premier polyèdre auto-assemblé à base d’ADN, un cube, a été construit par Seeman et ses collègues en 1991 (figure 50).77 Dans ce cube, chaque face est composée de quatre jonctions et chaque jonction présente trois bras avec des extrémités cohésives afin de lier avec un autre bout collant du bras voisin. Toutefois, cette procédure de synthèse
est très délicate et compliquée. Il demande des traitements enzymatiques répétés et des purifications, la synthèse n’est pas réalisée en une seule étape. Cette raison a donc encouragé de nombreuses recherches pour améliorer les moyens de fabrication des polyèdres à base d’ADN.
En 2004, Shih et ses collègues ont décrit la construction d’un octaèdre à base d’un brin long d’ADN.78 Ce long brin a été spécialement dessiné pour former une structure secondaire qui peut être ensuite repliée, avec l’aide d’un certain nombre de brins d’ADN courts, pour former un octaèdre. La cryomicroscopie électronique a permis d’observer le réseau octaédrique 3D formé (figure 51).
Le rapport de stage ou le pfe est un document d’analyse, de synthèse et d’évaluation de votre apprentissage, c’est pour cela chatpfe.com propose le téléchargement des modèles complet de projet de fin d’étude, rapport de stage, mémoire, pfe, thèse, pour connaître la méthodologie à avoir et savoir comment construire les parties d’un projet de fin d’étude.
|
Table des matières
1 Introduction
1.1 Description des briques de base et des concepts
1.1.1 Le Fullerène
1.1.1.1 La découverte du fullerène.
1.1.1.2 Production des fullerènes
1.1.1.3 Le fullerène C60
1.1.1.4 La fonctionnalisation du fullerène C60
1.1.2 Porphyrines et phtalocyanines
1.1.2.1 Les Porphyrines
1.1.2.1.1 Structure et nomenclature
1.1.2.1.2 Synthèse des porphyrines
1.1.2.2 Les phtalocyanines
1.1.2.2.1 Structure
1.1.2.2.2 Synthèse des phtalocyanines
1.1.3 Réaction « Click-Chemistry » et fonctionnalisation du fullerène C60 par la CuAAC
1.1.3.1 La click-chemistry
1.1.3.1.1 Généralité
1.1.3.1.2 Mécanisme de réaction
1.1.3.2 La fonctionnalisation du fullerène C60 avec la porphyrine par la CuAAC
1.1.4 Auto-assemblages de fullerènes
1.1.4.1 Polymère supramoléculaire de fullerène
1.1.4.2 Agrégats de dérivés de fullerène
1.2 Assemblages bio-dirigés
1.2.1 Contexte
1.2.2 ADN
1.2.2.1 Structure de l’ADN
1.2.2.2 Intérêt de l’ADN comme brique de construction
1.2.2.2.1 Auto-assemblage 2D
1.2.2.2.2 Auto-assemblage 3D à base d’ADN
1.2.2.2.3 Origami d’ADN
1.2.2.2.4 Assemblages d’ADN-molécules organiques
2 Objectif de travail
3 Auto-assemblage de dérivés fullerènes-chromophores
3.1 Introduction
3.2.1 Synthèse de la fulléropyrrolidine 7
3.2.2 Synthèse des chromophores porphyrines et phtalocyanines
3.2.3 Synthèse des dendrons contenant les chromophores
3.2.4 Synthèse des dyades par la CuAAC
3.3 Caractérisation
3.3.1 Fulléropyrrolidine 6
3.3.2 Chromophores
3.3.2.1 UV-Vis et IR
3.3.2.2 RMN
3.3.3 C60-Chromophores
3.3.3.1 UV-Vis
3.3.3.2 RMN
3.3.4 Electrochimie
3.3.4.1 Série C60-ZnP
3.3.4.2 Série C60-ZnPc
3.3.4.3 Série C60-ZnP/ZnPc
3.3.5 Caractérisation photophysique
3.4 Auto-assemblage
3.4.1 Analyse par microscopie à force atomique
3.4.1.1 C60-2ZnP 1
3.4.1.2 C60-2ZnPc 2
3.4.1.3 C60-ZnP/ZnPc 3
3.4.2 Analyse par microscopie électronique à balayage
3.5 Conclusion
4 Hybrides à base de molécules organiques et d’ADN
4.1 Introduction
4.2 Synthèse des hybrides à base de fullerène
4.2.1 Synthèse des bis-adduits de fullerène
4.2.2 Couplage du fullerène avec l’ADN
4.2.2.1 Couplage peptidique
4.2.2.2 Autres couplages
4.2.2.3 Couplage par CuAAC
4.3 Synthèse d’hybrides à base de porphyrines
4.3.1 Synthèse des adduits porphyrines/ADN
4.3.3 Gel électrophorétique
4.3.4 Spectres de masse
4.3.5 Assemblage des adduits A4 d’ADN/porphyrine avec des nanoparticules d’or
4.3.6 Hybridation des porphyrines avec des oligonucléotides complémentaires.
4.4 Synthèse et caractérisation des adduits ODN/adamantane
4.4.1 Première série
4.4.2 Deuxième série
4.4.2.1 Synthèse
4.4.2.2 Caractérisations
4.4.2.3 Hybridation des adamantanes avec des oligonucléotides complémentaires
4.5 Synthèse et auto-assemblage 3D à base du fullerène
4.6 Conclusion
5 Fonctionnalisation des nanotubes de carbone
5.1 Introduction et généralité sur les nanotubes de carbone
5.1.1 Structure et propriétés des nanotubes de carbone
5.1.2 Chimie des nanotubes de carbone
5.1.2.1 Fonctionnalisation covalente des nanotubes
5.1.2.2 Synthèse des dyades SWNTs-chromophores par la « click-chemistry »
5.2 Fonctionnalisation des nanotubes de carbone avec des dendrimères ZnP, ZnPc de première génération
5.2.1 Synthèse
5.2.2 Caractérisation
5.2.2.1 Spectres d’absorption UV-Vis et spectres d’émission
5.2.2.2 Spectroscopie Raman
5.2.2.3 Analyse XPS
5.2.2.4 Etudes d’AFM et de MEB
5.3 Fonctionnalisation des nanotubes de carbone avec des dendrimères de porphyrines et de phtalocyanines de deuxième génération
5.3.1 Synthèse
5.3.2 Caractérisation
5.3.2.1 Spectres d’absorption UV-Vis et spectres d’émission
5.3.2.2 Spectres Raman
5.3.2.3 Analyse XPS 1545.3.2 Caractérisation
5.3.2.1 Spectres d’absorption UV-Vis et spectres d’émission
5.3.2.2 Spectres Raman
5.3.2.3 Analyse XPS
5.4 Conclusion
5.4 Conclusion
6 Conclusion et perspective
7 Partie expérimentale
Télécharger le rapport complet