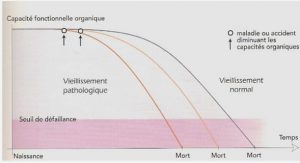
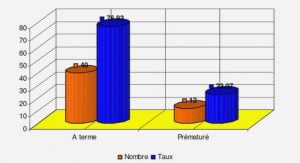
La défense des plantes
Les plantes font continuellement l’objet d’agressions d’agents pathogènes (bactéries, champignons, oomycètes…) occasionnant des maladies et engendrant des pertes agricoles considérables. Pour faire face à ces attaques, les plantes ont développé un certain nombre de mécanismes de défense leur permettant d’assurer leur protection. En effet, les cellules végétales présentent la particularité d’être entourée par une barrière physico-chimique de structure complexe, la paroi cellulaire. Cette paroi dont la composition et le mode d’action seront détaillés par la suite, permet ainsi d’empêcher la pénétration du pathogène ou tout du moins réduire et ralentir sa progression. Cela s’opère par une rigidification de la paroi avec notamment le dépôt de molécules de callose ou de lignine mais aussi l’intervention d’autres molécules pariétales telles que les extensines.
La plupart du temps, la présence d’un pathogène, et plus généralement d’un microorganisme, va être repérée grâce à des signaux particuliers détectés par la plante. Ces signaux peuvent être des molécules issues d’un pathogène et sont alors appelées des PAMPs (Pathogen-Associated Molecular Pattern) (Boller & Felix, 2009; Choi & Klessig, 2016; Yu et al., 2017). Elles peuvent aussi provenir d’un micro-organisme au sens large qu’il soit bénéfique, pathogène ou neutre, auquel cas elles sont définies en tant que MAMPs (Microbe-Associated Molecular Pattern) (Boller & Felix, 2009; Millet et al., 2010; Yu et al., 2017). Ces molécules peuvent également résulter de la dégradation de la paroi de la plante elle-même et sont par conséquent considérées comme des DAMPs (Damage-Associated Molecular Pattern) (Boller & Felix, 2009; Souza et al., 2017; Yu et al., 2017). Enfin, certaines molécules décrites plus récemment ont pour origine les nématodes et sont dénommées NAMPs (NematodeAssociated Molecular Pattern) (Manosalva et al., 2015; Choi & Klessig, 2016).
Ces MAMPs, PAMPs, NAMPs ou DAMPs peuvent être de nature très diverse et émaner aussi bien de structures entourant la cellule comme le peptidoglycane, la chitine, les lipopolysaccharides ou des fragments de pectines que de produits de sécrétion comme des antibiotiques, des antifongiques, de l’ADN, des métabolites, des sidérophores, des biosurfactants ou des composés volatiles organiques (Boller & Felix, 2009; Lanoue et al., 2010; Millet et al., 2010; Beauregard et al., 2013; Choi & Klessig, 2016; Kong et al., 2017; Souza et al., 2017; Yu et al., 2017). Ces composés sont reconnus par la cellule végétale via des récepteurs spécifiques nommés PRRs (Pattern Recognition Receptor) et vont avoir un effet éliciteur engendrant une réponse immunitaire rapide et efficace : la PTI (PAMP-Triggered Immunity) (Pieterse et al., 2009; Katagiri & Tsuda, 2010; Yu et al., 2017).
Dans le cas d’une élicitation avec la flagelline 22, ce peptide de 22 acides aminés et d’origine bactérienne est reconnu au niveau du récepteur transmembranaire FLS2 (FLagellinSensing 2). Cela entraîne alors un changement de la conformation de ce récepteur qui va pouvoir alors interagir avec un autre récepteur transmembranaire, BAK1 (Brassinosteroidinsensitive 1-Associated Receptor Kinase 1) et cette interaction va engendrer une cascade de signalisation aboutissant in fine au déclenchement d’une réponse immunitaire chez la plante (Boller & Felix, 2009) .
La réponse à une élicitation peut se traduire, entre autres, par un renforcement de la paroi via le dépôt de lignine ou de callose, un polymère de glucoses liés en β-1 3, par la production d’espèces réactives de l’oxygène aussi appelées ROS (Reactive Oxygen Species), une libération importante de calcium au niveau du cytosol, la fermeture des stomates et la surexpression de gènes liés à la défense codant, entre autres, pour les protéines PR (Pathogenesis-Related) ou les phytoalexines (Pieterse et al., 2009; Muthamilarasan & Prasad, 2013).
Néanmoins, la PTI peut dans certains cas être contournée ou inhibée par les pathogènes grâce à la libération d’effecteurs très spécifiques activant l’ETS (Effector-Triggered Susceptibility). En retour, la cellule ne sera pas nécessairement démunie puisqu’elle peut reconnaître et contrecarrer ces effecteurs grâce à des récepteurs intracellulaires : les protéines R (Résistance). Cette réponse constitue l’ETI (Effector-Triggered Immunity) et se traduit par des réponses similaires à la PTI mais plus rapides et de plus grande ampleur (Pieterse et al., 2009; Katagiri & Tsuda, 2010).
Souvent, l’ETI aboutit à une réponse hypersensible qui se caractérise par une mort cellulaire programmée. La compatibilité des effecteurs et de ces protéines R résulte de la coévolution de la plante et du pathogène, ce qui va déterminer lequel des deux prendra le dessus sur l’autre (Jones & Dangl, 2006; Katagiri & Tsuda, 2010; Gouveia et al., 2017) (Figure 3). Cette lutte est parfaitement résumée dans le modèle en « zig-zag » proposé par Jones & Dangl, 2006 .
Spécificité de la défense des racines
La racine est un organe souterrain servant d’ancrage à la plante et assurant des fonctions vitales telles que l’absorption d’eau et de nutriments. Son environnement suppose de nombreuses interactions avec une grande diversité d’organismes et de micro-organismes bénéfiques, neutres ou pathogènes, vivant dans le sol et composant ainsi la rhizosphère. Ces interactions sont autant de facteurs biotiques qui vont provoquer des réactions de défense chez la plante. Ainsi, pour faire face à ces menaces particulières la plante a mis en place un ensemble de défenses spécifiques au niveau de la racine (Erb et al., 2009; Balmer & MauchMani, 2013; Driouich et al., 2013). Toutefois, ces mécanismes de défense racinaire restent très peu étudiés à ce jour et ne sont pas encore complétement élucidés.
Les travaux réalisés jusqu’ici sur la défense au niveau racinaire indiquent que celle-ci présente des différences par rapport aux parties aériennes (Balmer & Mauch-Mani, 2013). En effet, une différence d’expression des gènes codant pour les protéines PR a été par exemple révélée entre le système racinaire et les parties aériennes du hêtre après inoculation par l’oomycète pathogène Phytophthora citricola (Schlink, 2010). Une différence de transcription a également été relevée chez le riz après inoculation avec le champignon Magnaporthe oryzae (Marcel et al., 2010) ou encore chez le maïs attaqué au niveau des feuilles par le papillon Spodoptera littoralis (Erb et al., 2009). Chez le maïs, des variations au niveau de l’expression de certaines protéines PR, notamment PR1 (Figure 5), ainsi que de la quantité de certaines phytohormones telles que l’acide jasmonique, l’acide salicylique et l’acide abscissique ont été décrites entre les feuilles et les racines en réponse à une infection par l’ascomycète Colletotrichum graminicola (Balmer et al., 2013). De plus, les auteurs ont noté que la réponse à ce pathogène était plus rapide chez la racine et que la progression de la maladie y était atténuée.
|
Table des matières
1 Introduction générale
1.1 La défense des plantes
1.2 Spécificité de la défense des racines
1.3 Interaction Phytophthora parasitica – racine d’Arabidopsis thaliana
1.4 La paroi cellulaire végétale: premier rempart cellulaire contre les pathogènes
1.4.1 Les Pectines
1.4.2 Les ArabinoGalactane Protéines
1.4.3 Les Extensines
1.5 Article 1: Root defence: how important are cell wall extensins?
1.6 Objectifs de thèse
2 Matériel et Méthodes
2.1 Matériel végétal
2.2 Culture d’Arabidopsis thaliana in vitro
2.2.1 Stérilisation des graines
2.2.2 Préparation du milieu de culture
2.2.3 Semis des graines in vitro
2.3 Phénotypage racinaire d’A. thaliana
2.3.1 Mesure de la longueur racinaire
2.3.2 Observation des cellules apparentées aux cellules bordantes (BLCs)
2.3.3 Mise en évidence du mucilage
2.4 Elicitation et traitement des racines
2.4.1 Elicitation avec la flagelline 22
2.4.2 Traitement des racines avec des anticorps monoclonaux anti-extensines
2.5 Immunolocalisation d’épitopes associés aux extensines et aux pectines
2.6 Phytophthora parasitica
2.6.1 Souches de Phytophthora parasitica
2.6.2 Préparation du milieu de culture
2.6.3 Repiquage en milieu solide
2.6.4 Repiquage en milieu liquide
2.6.5 Production de zoospores
2.6.6 Inoculation de racines d’A. thaliana avec des zoospores de P. parasitica
2.7 Extraction des Résidus Insolubles dans l’Alcool (AIR)
2.8 Analyse en chromatographie en phase gazeuse couplée à un détecteur à ionisation de flamme (GC-FID)
2.8.1 Dérivation des échantillons
2.8.2 Analyse en GC-FID
2.9 Analyse en chromatographie en phase gazeuse couplée à un spectromètre de masse (GC-MS)
2.9.1 Dérivation des échantillons
2.9.2 Analyse en GC-MS
2.10 Analyses statistiques
3 Résultats
3.1 Article 2: Extensin arabinosylation involvement in root response to elicitors and pathogenic oomycetes
3.2 Caractérisation préliminaire de mutants affectés dans la production de peroxydases
3.2.1 Introduction
3.2.2 Résultats
3.2.3 Conclusion
4 Discussion générale et perspectives
5 Références bibliographiques
Conclusion
Annexes