Télécharger le fichier pdf d’un mémoire de fin d’études
Facteurs de risque d’ostéoporose
Plusieurs facteurs de risque d’ostéoporose sont bien connus. Si certains sont inévitables, d’autres au contraire doivent être combattus. On retient dans les facteurs de risque modifiables : la consommation excessive d’alcool, le tabac, un faible IMC (Indice de Masse Corporelle), le manque d’activité physique, l’immobilisation prolongée, le défaut d’ensoleillement, les erreurs d’hygiène de vie et nutritionnelles (carence en calcium, vitamine D, malnutrition…).
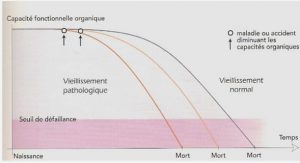
Enfin d’autres facteurs de risque ne peuvent être modifiés. On retiendra : le sexe féminin, une petite taille, l’ethnie caucasienne ou asiatique, l’antécédent d’ostéoporose et de fractures ostéoporotiques au premier degré, la ménopause précoce (constitutionnelle ou chirurgicale sans traitement hormonal), la puberté tardive, la prise de certains médicaments avec une attention particulière pour les corticoïdes, diverses maladies endocriniennes, génétiques, digestives, l’anorexie mentale, la malabsorption, les rhumatismes inflammatoires [1]. Enfin le vieillissement est un facteur de risque majeur d’ostéoporose. Pour un niveau de densitométrie osseuse donné, le risque de fracture du col fémoral s’accroit d’un facteur deux à partir de 65 ans et ce tous les dix ans [10].
Différents types d’ostéoporose
En raison des implications diagnostiques et thérapeutiques, il est important de distinguer l’ostéoporose primitive plus fréquente chez la femme (post-ménopausique) de l’ostéoporose secondaire plus fréquente chez l’homme, qui répond à des étiologies endocriniennes, métaboliques, toxiques, génétiques, iatrogènes…. Même si les causes peuvent être intriquées (Tableau 2). Environ un tiers des femmes ménopausées, la moitié des femmes pré ménopausées et des hommes présentent une ostéoporose secondaire [15].
La distinction n’est pas toujours aussi facile, car certains facteurs étiologiques peuvent révéler ou aggraver une ostéoporose initialement primitive. De plus, il existe un flou dans les limites de la distinction entre ostéoporose secondaire et certains facteurs de risque, dans tous les cas, il faudra s’atteler à rechercher une cause curable.
L’ostéoporose est donc une maladie multifactorielle qui résulte de la combinaison, en proportion variable, de très nombreux facteurs de risque liés à la génétique, à certaines particularités biologiques, au mode de vie, au comportement individuel, aux pathologies rencontrées et à leurs traitements, au vieillissement intrinsèque et inéluctable de l’individu. L’addition de plusieurs de ces facteurs va contribuer à diminuer la masse osseuse et altérer la microarchitecture, avec « in fine » une majoration du risque de fracture.
Approche diagnostique du risque de fracture
Le diagnostic d’ostéoporose doit être précoce, avant la survenue de fractures, considérées comme une complication de cette ostéopathie et non comme une manifestation initiale. Il faut donc savoir l’évoquer dans de multiples circonstances (fracture pour un traumatisme de faible énergie, perte de taille [16], rachialgie vive et brutale, déformation du rachis en cyphose…). Devant un tableau clinique évocateur d’ostéoporose, la démarche diagnostique comporte d’abord la recherche par l’interrogatoire et l’examen clinique de facteurs de risque d’ostéoporose, de chutes ou de ses complications. Il convient ensuite d’éliminer grâce à des examens complémentaires guidés par l’enquête clinique, une cause d’ostéoporose secondaire. Une cause tumorale ou traumatique de fracture doit également être écartée. Une ostéodensitométrie peut ensuite être effectuée, si l’on se trouve devant une indication reconnue de mesure de la densité minérale osseuse (DMO). Enfin certains outils tels que le FRAX® (Fracture Risk Assessment Tool) et le TBS (Trabecular Bone Score) peuvent aider à évaluer le risque de fracture et l’indication thérapeutique.
Facteurs de risque de fracture
Outre la mesure de la DMO, l’évaluation du risque de fracture repose sur la recherche d’antécédents personnels ou familiaux de fracture et les facteurs de risque d’ostéoporose et de chutes (tableau 3 et 4).
L’antécédent personnel de fracture est le facteur de risque le plus important d’une nouvelle fracture incidente à court terme. Le risque de nouvelle fracture est augmenté surtout dans les 2 à 3 ans qui suivent la fracture, mais il reste significatif jusqu’à 10 à 15 ans après la survenue de la première fracture. En cas de fracture vertébrale, le risque de nouvelle fracture est de 25% dans l’année qui suit [6]. Le nombre et le grade des fractures vertébrales sont des indicateurs de la gravité de l’ostéoporose [7]. Or la fracture vertébrale est fréquente mais sous-estimée (dans deux tiers des cas), à cause de son caractère parfois pauci ou asymptomatique, ne conduisant donc pas à la réalisation d’une radiographie. Une évaluation morphologique à la recherche de fractures vertébrales par radiographies standards du rachis dorso-lombaire ou Vertebral Fracture Assessment (VFA) lors de la réalisation de la densitométrie peut être utile dans l’évaluation du risque de fracture.
Le logiciel VFA est un logiciel optionnel installé sur les appareils d’ostéodensitométrie permettant de visualiser le rachis dorsal et lombaire de face et de profil et de dépister ainsi des déformations et fractures vertébrales. Il est indiqué notamment en cas de perte de taille ≥ 4cm (mesure de la taille comparée à la taille rapportée à l’âge de 20 ans) ou de perte de taille prospective ≥ 2cm (mesure répétée de la taille au cours du suivi). Cet examen comporte de nombreux avantages : rapide, peu irradiant et il peut se faire au décours d’une mesure de la densité osseuse. Contrairement à la radiographie standard, il peut être proposé à une population plus large pour rechercher les fractures vertébrales asymptomatiques. Il a une très bonne spécificité et sa très bonne valeur prédictive négative permet d’éviter la réalisation d’une radiographie chez un tiers des patients [17].
Les facteurs de risque de nouvelle fracture incidente à court terme sont, en plus, de la survenue d’une fracture récente, la présence de facteurs de risque de chute. Ce sont des facteurs déterminants dans la survenue de fractures non vertébrales essentiellement chez les sujets les plus âgés et/ou fragiles. La prévention des chutes fait donc partie intégrante des stratégies thérapeutiques dans l’ostéoporose [18].
Mesure de la densitométrie minérale osseuse
Définition densitométrique de l’ostéoporose
L’ostéoporose est une maladie cliniquement silencieuse, le diagnostic initial étant le plus souvent fourni par une fracture sentinelle à faible énergie. En l’absence de fracture, le diagnostic repose sur l’absorptiométrie biphotonique à rayons X (DXA) qui est la technique de référence pour mesurer la densité minérale osseuse au rachis lombaire et à l’ESF [2]. Elle permet de mesurer de façon fiable la densité osseuse qui est un bon reflet de la masse osseuse (densité surfacique du tissu minéralisé).
Les résultats peuvent être exprimés en valeur absolue, en g/cm2 d’hydroxyapatite, mais le plus souvent, afin d’interpréter le résultat de la DMO, celle-ci est comparé à une courbe de référence : valeurs moyennes au même site osseux de la DMO dans une population de référence. Ce résultat est exprimé en unité d’écart-type (ou déviation standard), selon deux valeurs : le T-score et le Z-score. Pour le Z-score la population de référence correspond aux sujets de même âge, de même sexe et de même origine ethnique. Tandis que pour le T-score, la population de référence est une population d’adultes jeunes de même sexe et de même origine ethnique.
Depuis 1994, la définition de l’ostéoporose proposée par l’OMS correspondant à un T -score ≤ -2,5 déviations standard (DS) (Tableau 5). Cette définition est fondée sur la valeur de la DMO mesurée au rachis lombaire et à l’ESF [17]. Il existe parfois une discordance entre le T-score lombaire et fémoral, dans cette situation on se fie au site dont la mesure est la plus basse.
Ces critères diagnostiques concernaient initialement uniquement l’ostéoporose post-ménopausique et n’étaient validés que chez la femme blanche d’Europe de l’Ouest et d’Amérique du Nord. En effet la classification de la DMO établie par l’OMS repose essentiellement sur des études de population menées auprès de femmes ménopausées. Il est maintenant établi que le même T-score, dérivé de différents sites et techniques de mesure, donne des informations différentes sur la prévalence de l’ostéoporose et sur le risque de fracture. Cette définition a donc été légèrement modifiée en 2008 par l’OMS : le site de mesure de référence est le col fémoral (meilleur prédicteur du risque de fracture de hanche) et les catégories diagnostiques sont applicables aux femmes ménopausées et aux hommes âgés de plus de 50 ans. La courbe de référence recommandée est la courbe NHANES III pour les mesures au col fémoral des femmes blanches de 20 à 29 ans, y compris pour les hommes et les femmes non blanches. La hanche est le site le plus pertinent cliniquement, car sa fracture est la principale complication de l’ostéoporose en matière de morbidité et de coût [20].
Le développement de la densitométrie osseuse a soulevé des questions quant à l’applicabilité de cette classification aux hommes, aux femmes non ménopausées et aux enfants. Il n’existe pas de consensus sur le diagnostic densitométrique dans ces populations. L’International Society for Clinical Densitometry (ISCD) propose d’utiliser le Z-score plutôt que le T-score chez les femmes avant la ménopause et chez les hommes avant 50 ans. Il est considéré que si le Z-score est inférieur à -2, il s’agit d’une densité anormalement basse [21]. Tandis que International Osteoporosis Foundation (IOF) recommande de maintenir l’utilisation de T-score, si la croissance est terminée et que les cartilages de conjugaison sont fusionnés avec les seuils traditionnels (T-score £ -2,5) [5].
Sites de mesures et indications
La DXA est un examen précis, peu irradiant, reproductible et rapide [22]. Elle doit être réalisée sur deux sites, de préférence le rachis lombaire et l’ESF. La mesure du radius repose sur des indications précises. Le rachis lombaire inclut 30 % d’os cortical et 70 % d’os trabéculaire. C’est le tissu osseux le plus sensible aux modifications hormonales ou aux pathologies. C’est donc le site idéal chez l’adulte jeune de moins de 65 ans, pour observer rapidement le retentissement d’une carence hormonale, d’une corticothérapie, d’une intoxication alcoolo-tabagique. En revanche, chez les sujets plus âgés, la densité osseuse vertébrale est majorée artificiellement par l’arthrose rachidienne. C’est une cause classique de surestimation de la densité osseuse et de faux négatif au cours de l’ostéoporose. Chez le sujet âgé, c’est donc la mesure de l’ESF, composé majoritairement d’os cortical qui est le site idéal pour évaluer la densité osseuse et le risque de fracture de l’ESF car il n’est pas influencé par l’arthrose. En pratique, avant 70 ans, la mesure couplée du rachis lombaire et de l’ESF apporte toutes les informations utiles. Après 70 ans, la mesure de l’ESF est suffisante car la mesure lombaire est artéfactée par l’arthrose [7].
Les indications de remboursement retenues par la Haute Autorité de Santé (HAS) dans son avis du 21 juin 2006, pour lesquelles le service attendu de l’ostéodensitométrie a été estimé suffisant, peuvent être regroupées en deux catégories : indications valables quel que soit l’âge ou le sexe et indications supplémentaires spécifiques à la femme ménopausée (Tableau 6). Elles sont posées en fonction de l’existence de facteurs de risque d’ostéoporose, de fracture vertébrale ou fracture périphérique sur traumatisme de faible énergie. De plus l’examen n’est justifié que si son résultat peut à priori conduire à une modification de la prise en charge du patient [23].
Après une fracture, la mesure de la DMO doit être réalisée à visée pronostique, et comme base de suivi du traitement, cependant il est important de retenir que ce n’est pas le seul élément à prendre en compte pour la décision thérapeutique. De plus la réalisation d’une DXA peut être utile lorsqu’elle est couplée à la réalisation d’un VFA pour rechercher d’autres fractures pouvant modifier la conduite à tenir [24].
L’ostéodensitométrie a quelques indications dans le suivi des patients et du traitement. Elle a pour objectif d’une part de vérifier l’absence de perte osseuse (définie par une diminution de 0,03g/cm2 de DMO) [6], et d’autre part d’évaluer la réponse aux traitements. En fin de séquence, elle permet également d’évaluer le risque de fracture dans les années qui suivent. L’absence de perte osseuse est l’objectif minimal pour tous les patients. Chez les patients avec une DMO fémorale très basse, l’objectif est une augmentation significative de la DMO, avec au minimum un T-score supérieur à -2,5 voir -2 au site fémoral [10].
|
Table des matières
INTRODUCTION
I. Généralités sur l’ostéoporose
A. Épidémiologie et conséquences
1. Épidémiologie de l’ostéoporose et des fractures
2. Conséquences de l’ostéoporose et des fractures ostéoporotiques
B. Physiopathologie et différents types d’ostéoporose
1. Physiologie du remodelage osseux
2. Variation de la masse osseuse
3. Facteurs de risque d’ostéoporose
4. Différents types d’ostéoporose
C. Approche diagnostique du risque de fracture
1. Facteurs de risque de fracture
2. Mesure de la densitométrie minérale osseuse
a. Définition densitométrique de l’ostéoporose
b. Sites de mesures et indications
c. Densité minérale osseuse et risque fracturaire
d. Limites
3. Fracture Risk Assessment Tool (FRAX®)
4. Trabecular Bone Score (TBS)
II. Allogreffe de cellules souches hématopoïétiques
A. Indication de l’allogreffe
B. Principes et méthodes de l’allogreffe
1. Conditionnement
2. Différents types de greffons
3. Choix du donneur
C. Complications et réactions immunologiques de l’allogreffe
1. Maladie du greffon contre l’hôte (GVH)
a. Classification GVH
b. GVH aiguë
c. GVH chronique
2. Autres réactions immunologiques et complications
III. État osseux des patients allogreffés
A. Avant allogreffe
B. Après allogreffe
C. Facteurs de risques de perte osseuse
1. Généraux
2. Cas particulier des glucocorticoïdes
D. Histoire naturelle
IV. Mise en place d’une filière
A. Traitement de l’ostéoporose
1. Mesures générales
2. Post-ménopausique
3. Cortico-induite
B. Après allogreffe : analyse de la littérature et recommandations
1. Effets des traitements sur la perte osseuse
2. Recommandations de la Société Francophone de Greffe de Moelle et de
Thérapie Cellulaire
C. Intérêt de notre étude
V. Objectif de l’étude
MATERIEL ET METHODES
I. Type et schéma de l’étude
II. Sélection des sujets
A. Critères d’inclusion
B. Critères d’exclusion
III. Recueil de données initiales
A. Évaluation hématologique
B. Évaluation rhumatologique
1. Facteurs démographiques
2. Facteurs de risque d’ostéoporose, fractures et chutes
3. Évaluation biologique
4. Évaluation densitométrique, TBS et FRAX®
5. Propositions thérapeutiques faites au cours de la première consultation
IV. Recueil de données à un an de l’allogreffe
A. Évaluation hématologique
B. Évaluation rhumatologique
1. Clinique
2. Évaluation biologique
3. Évaluation densitométrique, TBS et FRAX®
4. Propositions thérapeutiques faites au cours de la deuxième consultation
5. Évaluation de la prise en charge thérapeutique
V. Analyses statistiques
RESULTATS
I. Sélection de la population
II. Caractéristiques de l’allogreffe
A. Motif de greffe
B. Nombre de lignes de chimiothérapie
C. Conditionnement
D. Caractéristiques du greffon
E. Prévention des GVH
III. Caractéristiques de la population étudiée lors de la première consultation
A. Clinique
1. Démographique
2. Facteurs de risque d’ostéoporose, de chute et de fracture
B. Biologique
C. Données densitométriques
D. Score FRAX®
IV. Intervention proposée à l’issue de la première consultation
A. Explorations complémentaires
B. Interventions thérapeutiques
C. Accord inter-observateur de la première consultation
V. Caractéristiques de la population étudiée à un an
A. Maladie initiale
Télécharger le rapport complet